小さな緑藻を使って細胞の機能に迫る
箕浦 高子/中央大学理工学部准教授
専門分野 細胞生物学、生物物理学、生化学、分子系統学
細胞機能の基本、細胞骨格
私たちの体をつくっている一つひとつの細胞が、そのかたちを決めたり増殖したりできるのは、細胞内に存在する「細胞骨格」のおかげである。「骨格」という言葉からは何か固いものを連想しがちであるが、実際には、細胞骨格は非常にダイナミックな構造物である。細胞の分裂や、白血球やがん細胞の移動など、体内で見られるさまざまな運動現象のほとんどは、細胞骨格のはたらきによる。
細菌を除くすべての生物(真核生物)に共通する細胞骨格として、アクチン繊維と微小管という2種類の繊維がある。それぞれアクチン(球状アクチン)とチューブリン(α-チューブリンとβ-チューブリンからなる二量体)とよばれる単位タンパク質で構成され、三次元的なネットワークを形成している(図1)。アクチンもチューブリンも、真核生物が誕生してすぐに現れたと考えられているが、その構造は進化の過程でほとんど変わっていない(たとえば、後述するクラミドモナスとヒトとで比較しても、アクチンもチューブリンもほぼ同じアミノ酸配列である)。細胞骨格が非常に重要な機能をもつがゆえに、長い年月を経ても、配列が変わる余地がなかったのだと思われる。
アクチンとチューブリンの重要な性質のひとつは、条件に応じて、それ自体が集合・解離して、繊維を形成したり解体したりすることである。もう一つの特徴は、形成された繊維が、力を発生するタンパク質(モータータンパク質という)と相互作用して、運動をつくり出すことである(このときのエネルギーはATPという物質の分解によって供給される)。アクチンやチューブリンのこのような性質が、細胞のかたちや運動の基礎となっているのである。たとえば細胞分裂の際には、新しくできる2つの細胞に染色体が分配されるが、これは微小管のはたらきによる。それ故、微小管の機能を阻害して細胞の増殖を抑える薬物は、抗がん剤として広く使われている。また、染色体が分配された後に2つの細胞をくびり切る過程には、アクチン繊維がはたらく。このように、アクチンとチューブリンは細胞の基本的な機能においてきわめて重要なタンパク質であるが、これらの分子構造と、繊維形成や運動などの機能との関係については、まだよくわかっていないことも多い。
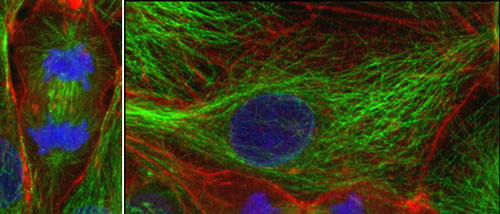
図1 動物培養細胞の細胞骨格
左は細胞分裂中の細胞。アクチン繊維(赤色)、微小管(緑色)、核(染色体)をそれぞれ特異的に蛍光標識し、共焦点顕微鏡で観察したもの。
細胞骨格研究で活躍するクラミドモナス
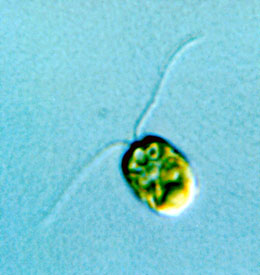
図2 クラミドモナス
体長は約10μm(0.01 mm)。
私たちが研究材料にしているのは、クラミドモナスという単細胞の緑藻である(図2)。2本の鞭毛を使って水中を遊泳する。クラミドモナスは植物と同じ葉緑体をもつので光合成の研究にも使われるが、鞭毛の構造もヒトやその他の生物の繊毛・鞭毛と共通しており、細胞骨格や繊毛・鞭毛研究のモデル生物でもある。これまでに、クラミドモナスを使ってはじめてもたらされた重要な発見が数多く存在する。
クラミドモナスが実験材料として優れている最大の理由は、細胞中の染色体セットが1組しかないことである(ヒトを含む多くの生物は、1つの細胞内に父方と母方の染色体セットを2組もつ)。染色体セットが1組しかなければ、その中のある遺伝子に突然変異が生じると、その効果(表現型)がすぐに現れる。2セットあると(もう1セットにある同じ遺伝子が変異の影響を補うことが多いので)、表現型が現れにくい。つまりクラミドモナスでは突然変異体を圧倒的に得やすいのである。これまでに、鞭毛運動や光合成に重要な各種の遺伝子の突然変異株を使った研究が数多く行われてきた。ある突然変異株の原因遺伝子とその表現型がわかれば、その遺伝子がつくるタンパク質の機能に関する大きな手がかりが得られるからである。
チューブリン遺伝子の破壊株
私たちの研究グループでは、こうしたクラミドモナスの利点を生かし、細胞骨格に関するさまざまな研究を行ってきた。過去にはアクチン遺伝子の突然変異株を得ることに成功し、その変異株の解析からいくつかの興味深い事実を発見した。そして数年前からチューブリンの機能的研究を開始し、現在はその研究に力を入れている。
クラミドモナスでチューブリン研究を展開するにあたり、問題点があった。この生物にはα-チューブリンとβ-チューブリンの遺伝子が2個ずつあり、それらの遺伝子から全く同じアミノ酸配列のα-チューブリンタンパク質、β-チューブリンタンパク質がつくられるのである。つまり、チューブリン遺伝子に関しては、クラミドモナスも染色体を2セットもつ他の生物と同じように、チューブリン遺伝子のどれか1つに変異が生じても、表現型が現れるとは限らないのである。また、たとえ表現型が現れたとしても、4つのチューブリン遺伝子のうちのどの変異かを特定するためには、すべてのチューブリン遺伝子を調べなければならない。そこで私たちはまず、その困難を回避するために、これらのチューブリン遺伝子の1つが破壊された株を取得することにした。そして、ゲノム内のランダムな箇所に特殊な遺伝子断片(カセット)が挿入された約8000株をスクリーニングして、4種のチューブリン遺伝子のうち3種の破壊株を得ることに成功した(京都大学との共同研究)。残る1種はアメリカの研究グループによって得られ、4種すべての破壊株を揃えることができた。
新たなチューブリン変異株の大規模単離
それらの株を掛け合わせてα-チューブリンとβ-チューブリンの遺伝子が1つずつになった株を作製した。この株を用いて、現在大規模な突然変異の誘発を始めている。手始めに、変異誘発処理を行った細胞集団から微小管重合阻害剤プロピザミドに耐性を示す株を選別したところ、非常に高い頻度でβ-チューブリン内のアミノ酸の1つが別のアミノ酸に置換した突然変異株が得られた。コンピューター計算により予測したクラミドモナスのチューブリンヘテロ二量体の立体構造上では、変異箇所はいずれも互いに近接し、二量体の中間部付近に集中していた(図3)。さらに、別の微小管重合阻害剤オリザリンに耐性を示す株も得られたが、これらにはオリザリンが結合するα-チューブリン内のアミノ酸に置換が見られた(図3)。これらの株では、アミノ酸の置換によってチューブリンの構造が変化し、プロピザミドやオリザリンへの耐性をもたらしたと考えられる。
今回の試行では、半年間ですでに15種以上の新たなチューブリン変異株が得られている。これまでにクラミドモナスのチューブリン変異株は5種しか報告されていないことを考えると、チューブリン遺伝子を単一化した株を親株として用いる今回の方法は、画期的に効率が良いと言える。今後も微小管重合阻害剤への超感受性や運動性異常などの異なる指標でチューブリン変異の選別を続け、さまざまなチューブリン変異株の取得をめざしたい。そのことにより、特定のアミノ酸の置換がどのような機能異常や特性の変化をもたらすかを探り、チューブリンの構造と機能を包括的に理解したいと考えている。その知見は生物科学の基礎としてはもちろん、がん研究など、医学にも重要であるに違いない。
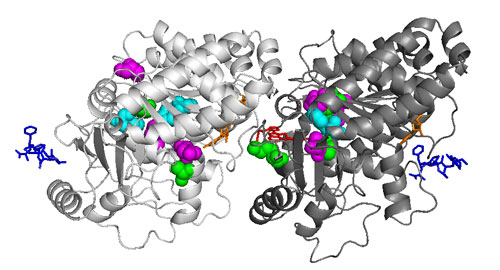
図3 クラミドモナスのチューブリンヘテロ二量体の構造
左、α-チューブリン;右、β-チューブリン。今回単離したチューブリンの突然変異株では、着色したアミノ酸が別のアミノ酸に置き換わっていた。
- 箕浦 高子(みのうら・たかこ)/中央大学理工学部准教授
専門分野 細胞生物学、生物物理学、生化学、分子系統学 - 三重県出身。 1969年生まれ。 1991年名古屋大学理学部卒業。
1994年名古屋大学大学院理学研究科博士前期課程修了。
1997年同大学院博士後期課程単位取得満期退学。
博士(理学)名古屋大学
岡崎国立共同研究機構基礎生物学研究所助手、筑波大学文部科学技官、東京大学大学院総合文化研究科助手、学習院大学理学部助教を経て2008年より現職。
細胞骨格タンパク質と、それらが担う細胞の形態形成や細胞運動について、主に細胞生物学的な方法を用いて研究している。主要著書に、『ベーシックマスター細胞生物学』(共著、オーム社、2009年)、『分子遺伝学 2版』(デザインエッグ社、2019年)などがある。









