 一覧
一覧

大石 克嘉 【略歴】
教養講座
炭酸ガス(CO2)分離・回収技術とその周辺
大石 克嘉/中央大学理工学部教授
専門分野 固体化学、材料物性
はじめに
本稿では、今後応用が期待される炭酸ガス分離・回収技術とそれに使用される吸収材について述べられています。文中の炭酸ガスとは、二酸化炭素(CO2)を指しています。
炭酸ガス(CO2)分離・回収技術がすこし知られるようになった理由
炭酸ガス回収・分離技術がかなり注目されるようになった理由は、地球温暖化が炭酸ガスの排出量と関係しているのではないかという報道やテレビ番組によると思われます。そこで本稿ではまず、地球温暖化の簡単な歴史と原因について触れた後、炭酸ガス分離・回収技術に関する研究について述べていきたいと思います。
既報の報告1)によれば、地球温暖化が問題視されはじめた発端は、1988年のアメリカ上院の公聴会におけるジェームズ・ハンセン氏(アメリカ航空宇宙局NASA所属)の「最近の異常気象、とりわけ暑い気象が地球温暖化と関係していることは99%正しい」という発言にあると考えられています(当時アメリカでは、猛暑と旱魃が大きな問題となっていた)。同じ年(1988年)に、気候変動に関する政府間パネル(Intergovernmental Panel on Climate Change 以下、IPCC)が設立され、温暖化の原因追及が行なわれ始めました(が、当初、温暖化の原因として疑われたのは、炭酸ガスではなく、太陽であったということです)。その後、1992年のリオデジャネイロで開催された地球サミットでの「気候変動枠組条約」の採択を経て、1997年京都での同条約の締約国会議(COP3)で京都議定書が採択され、温室効果ガスの排出削減(炭酸ガス限定ではない)が義務づけられました。
ではなぜ、炭酸ガスが地球温暖化の主な原因であると言われるようになったかと言うと、古くは太陽系の他の惑星である金星と火星の研究によるようです。解説1)によると、金星の表面温度(気温)は約500℃と推定されますが、この金星の気温は太陽との距離を考慮しても高すぎるようです。また、金星の大気は、少量の窒素が含まれるものの、残りのほとんどが炭酸ガスであり、かつその圧力は約90気圧であるそうです。温室効果もしくは温室効果ガスという概念が考え出されました。このあたりから、温室効果ガス = 炭酸ガス(実際には、温室効果ガスの1つ)ではないかと疑われるようになりました。さらに、2004年に、アメリカの古気候学者であるマイケル・マン等が、過去1000年における気温の変化を推定したグラフを発表しました。IPCCはこのグラフ上の結果をもとに、20世紀後半の気温が過去1000年で最も高く、かつその気温の上昇は過去に見られないほど急激であると主張するようになりました。さらに、スクリップス海洋研究所のチャールズ・キーリングの研究グループが、1957年の国際地球観測年以来ハワイのマウナロア観測所で大気の観測を続けており、大気中の炭酸ガス濃度が徐々に高まっていることを明らかにしました。その急激な気温上昇と1960年以降の炭酸ガス排出量の急増が一致しているように見えること、さらにIPCCは、自然変動と温室効果ガスの増加などの人間活動の要因を加えたコンピュータシミュレーションにより気温の変動の計算を行なった結果を示すことにより、地球温暖化の原因である主な温室効果ガスは炭酸ガスではないかという見方を主張するようになりました。この状況に付随して、発電所や鉄工所などから排出される炭酸ガスを分離・回収することにより、炭酸ガスが大気中に放出されることを防ぐ技術が注目されるようになってきたのです。
地球温暖化の主な原因は本当に炭酸ガス(CO2)なのか?
マスコミの報道により、炭酸ガスが地球温暖化の主な原因であるという説が有力視され、広まりました。しかしながら、その説に反論する書籍も見られます。その理由として、「水蒸気も温室効果ガスの1つであること、同時に地球での温室効果ガスの約90%が水蒸気であり、炭酸ガスは10%ほどで少ないこと」が上げられます。また、環境省において年間排出量などが把握されている温室効果ガスとしては、二酸化炭素(CO2)、メタン(CH4)、亜酸化窒素 (N2O)、ハイドロフルオロカーボン類(HFCs)、パーフルオロカーボン類(PFCs)、六フッ化硫黄(SF6)の6種類が報告されています。さらに報告2)によると、亜酸化窒素(N2O)は、炭酸ガスの310倍の温室効果を示すと予想されています(少ない量で温室効果が発生する可能性がある)。さらに、地球が温暖化する他の要因として以下が予想されています(すべてではないですが)1)。
1:太陽の活動度の大小 → 太陽エネルギーの増減 → 日射量の増減
2:地球磁場の変化 → 宇宙線量の変化 → 雲の発生量の増減 → 日射量の増減
3:火山の噴火 → 火山灰などの微粉末増加 → 日射量の増減
4:ミランコビッチ・サイクル → 地軸の傾きの変化 → 日射量の増減
5:温室効果ガス(すでに述べた)
上記理由の中の太陽の活動について考えてみますと(太陽の活動は地球の気温に大きく影響すると思われます)、古くから太陽の活動度の大小により地球の気温は、各時代で変動していて、暖かい期間と寒い期間があったと予想されています1)。ただし、変動周期の歴史は少なくとも数十年(50年弱くらいか)周期であると考えられており、したがって地球の気温変動を数年で判断することは出来ないと考えられています。また、この話しに多少付随したものとして、2008年7月北海道の洞爺湖で開催されたサミット(G8)での以下の結論があるかと思います。
「我々(G8)は国連気候変動の全ての参加国とともに、2050年までに世界全体の温室効果ガスを半減するという長期目標を共有することを目指し、すべての参加国とともに今後の同条約交渉のなかでこの目標を検討し、採択することを目指す。」
この結論では、“42年後までに”という長期的な見通しが示されています。この長期的に考えていくという結論となるのは、地球温暖化の原因を、短期間で完全に特定することは難しいだろうということがその理由ではないかと推定されます(あくまで推定です)。また、ご存知のように、3月11日の大震災により発生した福島原発の事故により原発反対の意見が強く上がっており、風力、水力、太陽光発電などを推進する意見が上げられていますが、震災後、最も稼働した発電方法は火力発電であったことは否定できません。さらにそのような状況において、理由はわかりませんが、最近カナダは、京都議定書から正式に脱退することを示しました。
以上より、地球温暖化の主な原因が炭酸ガスではないかという考え方の他に、種々の要因が考えられていて、現時点ではすぐにその原因を特定できないということが現状だと思われます。ただ、明らかなこともあります。それは、私たちが節電(省エネ)を推進し、これまでの生活スタイルを変えてゆくことだと考えられます。
それでも炭酸ガス(CO2)分離・回収技術や分離・回収材料は必要
炭酸ガスが地球温暖化の主な原因かどうかは別として、炭酸ガスが温室効果をもつことは事実ですので、現在実際に役立っている炭酸ガス分離・回収技術及び将来的に役立つであろう同技術を、私の研究室で研究している吸収材料も紹介しながら紹介します。
1番目は、火力発電時に発生する混合ガス(炭酸ガスを含む)から炭酸ガスのみを分離・回収する場合です。火力発電は、石油・石炭・天然ガス・廃棄物などを燃焼させた(酸素と反応させた)際に発生する熱で水を沸騰させて、その蒸気でタービンを回転さることにより発電する方式です。石油や天然ガスを燃焼させると、水蒸気(H2O)と炭酸ガス(CO2)が発生しますので、炭酸ガス吸収材を使ってCO2のみを分離・回収します。メタンを例に取ると図1の反応式となります(実際には、排出される混合気体には、水蒸気の他、窒素(N2)や未反応の酸素(O2)なども含まれていると思われます)。

図1 メタン(CH4)を燃焼させた(酸素と反応させた)場合の反応式と炭酸ガス吸収
2番目は、火力発電に使用される天然ガスや石油の成分である炭化水素をそのまま燃焼させるのではなく、触媒と水を使用して、炭化水素を炭酸ガスと水素に分解して水素のみを得る技術があります。それは炭化水素の水蒸気改質反応と呼ばれています。この水蒸気改質反応を、炭化水素の1つであるメタン(CH4)を例に取り図2に示します。まず、メタン(CH4)を水(H2O)と反応させて一酸化炭素(CO)と水素(H2)に変えます。その後、残った一酸化炭素(CO)をさらに水と反応させることにより、炭酸ガス(CO2)と水素(H2)に変えます。この反応を速めたり、また水素を分離する時に、炭酸ガス吸収材が使用されています。昭和電工グループでは、実際にこの方法で分離した水素(H2)を、アンモニア(NH3)の合成に使用しており、合成されたアンモニア(NH3)が販売されています。

図2 メタン(CH4)の水蒸気改質反応と炭酸ガス吸収
実際に応用されているもしくは、今後応用が期待される炭酸ガス吸収材としては、液体系としてはアミン3)や水に溶解させたK2CO34)が、固体系ではソーダライム(Ca(OH)2とごく少量のNaOHの混合物)やCaO、またLi系複合酸化物(Li4SiO45)、Li2CuO26)など)が期待されています。特に、水に溶解させたK2CO3は、実際に、水蒸気改質反応時の炭酸ガス吸収材として使用されています4)。その際の反応を図3に示します。炭酸ガスは、水中でK2CO3と反応し水溶液中に取り込まれます。逆に、一旦取り込まれた炭酸ガスを放出させるためには、温度を上げて反応を逆方向(←)に進行させます。その他、同じような水溶液の形での使用が期待されている物質としては、アミン系のモノエタノールアミンがあります。これは、常温で液体であり、水と混ぜて10%~20%濃度に調整して、発電所から排出される混合気体から炭酸ガスを吸収する際の利用が考えられていますが、実際にはまだ使用されてない模様です。
K2CO3(水溶液) + H2O(水) + CO2(気体) ⇔ 2KHCO3(水溶液)
図3 水溶液系炭酸ガス吸収物質。水溶液であるため高温では使用できない
これに対して、固体型の酸化物は図4に示す反応式で炭酸ガスと反応し、炭酸ガスを固体化(CaCO3やLi2CO3)します。固体であるため発電所の排出口などのかなりの高温箇所で使用可能であり、固体であるが故にコンパクトであり場所を取りません。炭酸ガスの放出には、加熱することにより温度を上げて逆方向(←)に反応を起こします。このため、これら材料は、1回の使用ではお払い箱とはなりません。何回使用可能であるかがとても重要な研究のポイントの1つです。使用される場合には、顆粒状、微粉末状の形状が考えられています。ただし問題点として、一旦吸収させた炭酸ガスを放出させる時加熱が必須である点であり、その際にエネルギーが必要となる点です。さらに、問題点を見てみると、Ca(OH)2やCaOは安価ですが、塩基性が強く、また炭酸ガス吸収時の膨張率が大きいため、排出口に充填する際に工夫がいります。また、一旦吸収した炭酸ガスを放出させる(CaCO3をCO2とCaOに戻す)温度が高いため、実施に応用するには難しい可能性があります。これに対して、Li系複合酸化物は脱炭酸温度がCaCO3と比較的低いですが、Liが高価であるという問題点があります。このため、何か特殊な形状や使用方法を考えないと応用は難しいと考えられます。
Ca(OH)2(固体) + CO2(気体) ⇔ CaCO3(固体) + H2O(水)
CaO(固体)+ CO2(気体) ⇔ CaCO3(固体)
Li4SiO4(固体) + CO2(気体) ⇔ Li2CO3(固体) + Li2SiO3(固体)
Li2CuO2(固体) + CO2(気体) ⇔ Li2CO3(固体) + CuO(固体)
図4 固体系炭酸ガス吸収物質。固体であるため,高温でも使用できる
上記問題点を解決するために、図5に示すような特殊な形状をもつ固体型炭酸ガス吸収材を考案します。Li4SiO4とLi2CuO2は、中心金属としてSiとCuを含んでいますので、これら金属を中心にしてその表面上に酸化ケイ素(SiO2)や酸化銅(Cu2O、 CuO)層を形成させ、さらにその上にLi4SiO4とLi2CuO2層を形成させた炭酸ガス吸収材の作製を行なっています。この構造(形状)の場合、一旦吸収させた炭酸ガスを放出させるには、中心金属に電流を流すことにより吸収材自身を加熱し温度を上げるプロセスとなります。また、図5に示されるワイヤ型吸収材を図6に示されるようなスパイラル(バネ)状にすることにより、狭い場所でも表面積を大きくすることが可能となると考えられます。このようにすることにより、固体のコンパクト性を最大限に生かした、場所を取らない新しい炭酸ガス吸収材が実現されると期待しています。本吸収材の応用分野としては、電気自動車のバッテリー用の炭酸ガス吸収として考えています。近未来的な電気自動車用バッテリーの1つに、大気中に豊富に存在する酸素を燃料の1つに使用する「金属-空気バッテリー」があります。このバッテリーでは、大気中から酸素を導入しますが、その際大気中の炭酸ガスがバッテリー内に入ってしまいます。その際、炭酸ガスはバッテリーに悪影響を及ぼすため、吸収材でカットされなければなりません。
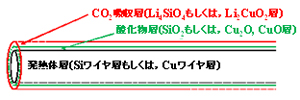
図5 表面に酸化物層とCO2吸収層を形成させた金属ワイヤ

図6 左の金属ワイヤ状炭酸ガス吸収材をスパイラル状に成形させた場合
おわりに
以上本稿では、炭酸ガス(CO2)分離・回収技術とその吸収材について述べてきました。これら吸収材を実際に応用するには、まだまだ課題が多くあり、今後、基礎と応用の両面からさらなる研究が必要と考えられますが、炭酸ガス(CO2)吸収材はこれからの時代に必要な材料の1つであると思われます。
参考文献
- 1) 丸山茂徳著、科学者の9割は「地球温暖化」CO2犯人説はウソ。だと思っている(宝島社新書)
- 2) 公益財団法人 地球環境産業技術研究機構、調査研究レポート
- 3) 三村富雄、 熊沢英博、八木靖幸、高品徹、吉山隆士、本田昭洋、化学工学論文集、 32、 236 (2006 ).
- 4) 昭和電工株式会社、化学品事業部門、川崎事業所パンフレット.
- 5) M. Kato、 and K. Nakagawa、 J. Ceram. Soc. Japan、 2001、 109、 911.
- 6) Y. Matsukura, T. Okumura、 R. Kobayashi, K. Oh-ishi, Chem. Lett., 2010, 39, 966.
- 大石 克嘉(おおいし・かつよし)/中央大学理工学部教授 理学博士
専門分野 固体化学、材料物性 - 静岡県生まれ。1986年中央大学理工学部工業化学科卒業。
1988年東北大学大学院 理学研究科化学専攻博士前期課程修了。
1991年東北大学大学院 理学研究科化学専攻博士後期課程修了。理学博士(東北大学)
1991年(株)東芝に入社、勤務後、中央大学理工学部助教授、准教授を経て2008年より現職。機能性無機材料の研究、開発に従事。